Gan nhiễm mỡ do rối loạn chuyển hóa (MAFLD) đang gia tăng nhanh chóng cùng với làn sóng béo phì toàn cầu. Không còn là hai bệnh lý riêng lẻ, MAFLD và béo phì thực chất là hai biểu hiện gắn liền của cùng một nền bệnh chuyển hóa, trong đó mỡ tích tụ quá mức không chỉ làm tăng vòng eo mà còn âm thầm tổn thương gan. Trong bối cảnh nhiều người chưa nhận thức đầy đủ về mối liên hệ này, việc hiểu rõ cơ chế, nguy cơ và cách điều trị MAFLD thông qua kiểm soát cân nặng và cải thiện lối sống trở nên cấp thiết hơn bao giờ hết.
Gan nhiễm mỡ do rối loạn chuyển hóa (MAFLD) là gì?
Khái niệm MAFLD – metabolic dysfunction-associated fatty liver disease (bệnh gan nhiễm mỡ do rối loạn chuyển hóa) ra đời nhằm thay thế cho cách gọi cũ là NAFLD – bệnh gan nhiễm mỡ không do rượu, vốn tồn tại nhiều bất cập trong thực hành lâm sàng. Hiệp hội Gan mật châu Á – Thái Bình Dương (APASL) là tổ chức đầu tiên chính thức công nhận và ủng hộ định nghĩa MAFLD, với cách tiếp cận tập trung vào yếu tố rối loạn chuyển hóa – cơ chế nền tảng thúc đẩy sự phát triển của bệnh.
Theo hướng dẫn, một người được chẩn đoán MAFLD khi có bằng chứng gan nhiễm mỡ (thông qua sinh thiết, các chỉ số sinh học không xâm lấn hoặc hình ảnh học như siêu âm, cộng hưởng từ…) kèm theo ít nhất một trong ba yếu tố thừa cân hoặc béo phì, đái tháo đường típ 2 (T2DM) hoặc có dấu hiệu rối loạn chuyển hóa rõ ràng dù cân nặng bình thường.
Các nghiên cứu gần đây cho thấy, định nghĩa MAFLD vượt trội hơn NAFLD trong việc nhận diện nhóm bệnh nhân có nguy cơ cao mắc biến chứng gan và bệnh lý ngoài gan, cũng như nhóm có chỉ định xét nghiệm di truyền hoặc mắc đồng thời các bệnh gan khác. MAFLD cho phép phân loại người bệnh thành ba nhóm lâm sàng có đặc điểm và tiên lượng khác nhau, bao gồm nhóm mắc đái tháo đường, nhóm thừa cân/béo phì và nhóm gầy nhưng có rối loạn chuyển hóa.
Việc phân nhóm này giúp định hướng điều trị phù hợp, đồng thời thúc đẩy cách tiếp cận toàn diện hơn, lấy người bệnh làm trung tâm, công bằng và lâm sàng hơn trong bối cảnh bệnh gan ngày càng gắn chặt với rối loạn chuyển hóa toàn thân.
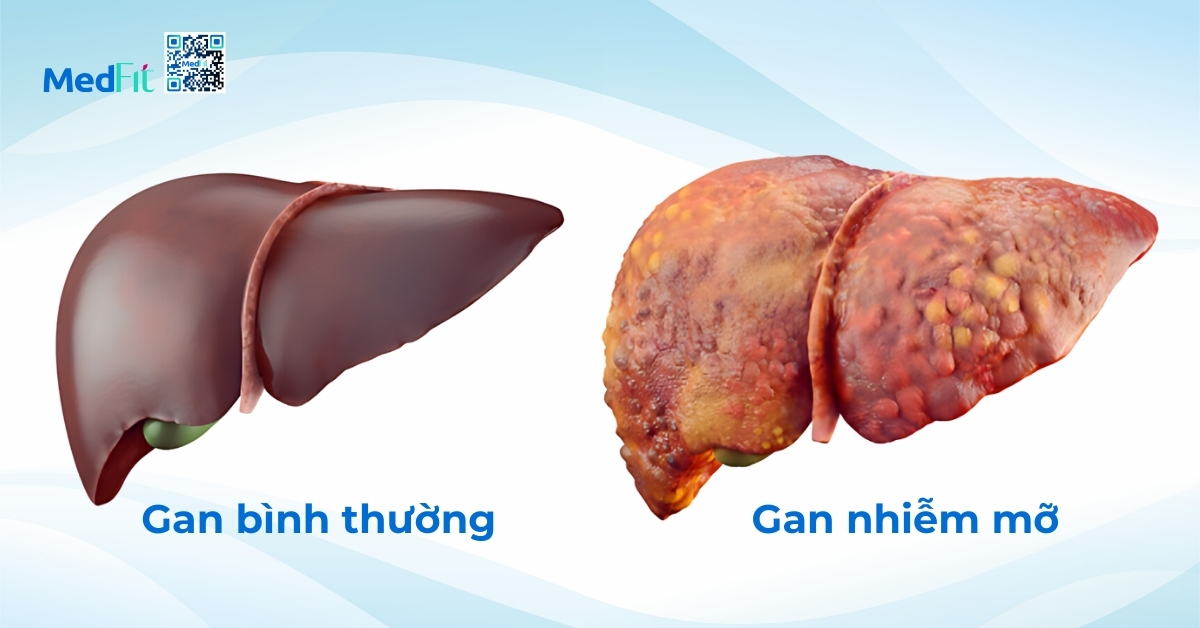
Những ai có nguy cơ mắc MAFLD cao?
MAFLD là một bệnh lý phức tạp, hình thành từ sự tương tác nhiều chiều giữa các yếu tố nguy cơ như béo bụng, T2DM, rối loạn mỡ máu và yếu tố di truyền. Những yếu tố này được chia thành hai nhóm, bao gồm có thể thay đổi được (như chế độ ăn, vận động, cân nặng) và không thể thay đổi (như tuổi tác, giới tính, yếu tố di truyền).
Tăng cân và béo phì có mối liên quan chặt chẽ với MAFLD và tỷ lệ mắc bệnh tăng theo chỉ số khối cơ thể (BMI). Tuy nhiên, ngày càng có nhiều bằng chứng cho thấy béo bụng, tức tích mỡ chủ yếu ở vùng bụng, đóng vai trò quan trọng hơn trong việc gây ra và làm nặng thêm bệnh. Điều này đặc biệt đúng với người châu Á, vốn có xu hướng tích mỡ bụng nhiều dù BMI còn trong giới hạn bình thường.

T2DM là một trong những yếu tố nguy cơ chính của MAFLD. Ước tính, có tới 65% người mắc T2DM đồng thời mắc MAFLD. Bên cạnh đó, rối loạn lipid máu, đặc biệt là tăng triglyceride và giảm HDL cholesterol, cũng làm tăng nguy cơ mắc bệnh gan nhiễm mỡ.
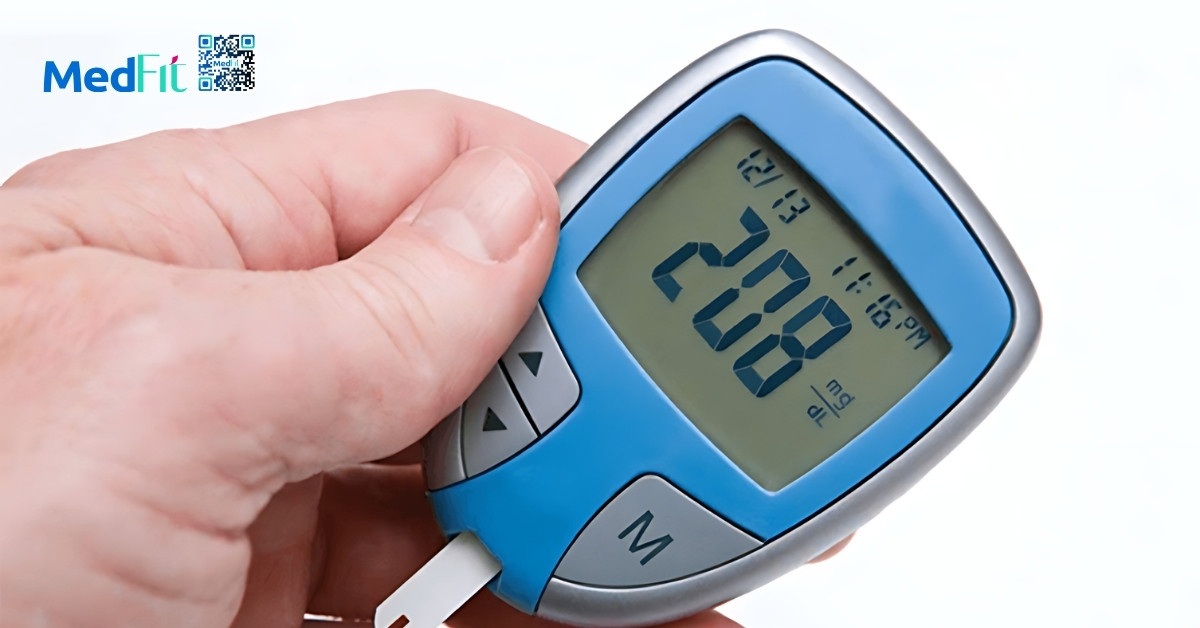
Đáng chú ý, không chỉ người thừa cân hay béo phì mới có nguy cơ mắc MAFLD. Một số nghiên cứu cho thấy tăng cân dù chưa đến ngưỡng thừa cân cũng có thể góp phần vào cơ chế bệnh sinh của MAFLD. Tổng hợp từ 93 nghiên cứu ở 24 quốc gia cho thấy, 19% người mắc MAFLD có thân hình gầy (lean MAFLD) và 41% không béo phì. Mức độ tổn thương gan của nhóm gầy và nhóm béo phì không khác biệt rõ rệt. Đặc biệt, khoảng 1/3 số người có BMI bình thường nhưng mắc MAFLD lại đáp ứng tiêu chuẩn hội chứng chuyển hóa.
Lối sống ít vận động là một yếu tố nguy cơ phổ biến khác của MAFLD. Tình trạng mất khối cơ (sarcopenia) có mối liên hệ hai chiều với MAFLD vì cả hai chia sẻ nhiều cơ chế bệnh sinh chung. Sự hiện diện của mất cơ không chỉ làm tăng nguy cơ mắc MAFLD mà còn liên quan đến mức độ xơ hóa gan nặng hơn. Một dạng tổn thương cơ khác là nhiễm mỡ cơ (myosteatosis), tức sự tích tụ mỡ trong các sợi cơ, cũng được xem là yếu tố thúc đẩy bệnh tiến triển, ngay cả ở người không béo phì.
Chế độ ăn giàu calo hoặc nhiều đường fructose cũng góp phần quan trọng, ngay cả khi người bệnh không béo. Các nghiên cứu gần đây còn chỉ ra rằng, hệ vi sinh đường ruột và các chất chuyển hóa do vi khuẩn tạo ra đóng vai trò thiết yếu trong việc khởi phát MAFLD. Ngoài ra, một số bệnh lý nền khác như ngưng thở khi ngủ, suy giáp, buồng trứng đa nang và suy tuyến sinh dục cũng được ghi nhận là yếu tố thúc đẩy bệnh.
Về phía các yếu tố không thể thay đổi, nghiên cứu trên hơn 73.000 người Trung Quốc cho thấy nam giới và người lớn tuổi có nguy cơ cao hơn mắc MAFLD. Ngoài ra, các yếu tố di truyền như đột biến gen PNPLA3, TM6SF2, MBOAT7 có liên quan đến toàn bộ phổ biểu hiện của bệnh MAFLD từ nhẹ đến nặng. Bên cạnh đó, các yếu tố biểu sinh (epigenetic) và hiện tượng rút ngắn telomere trong tế bào gan, vốn thường thấy khi xơ hóa tiến triển, cũng đang được nghiên cứu như một phần trong cơ chế bệnh sinh của MAFLD.

* Voucher chỉ áp dụng cho khách hàng thăm khám lần đầu tiên tại Phòng khám MedFit
Mức độ MAFLD được đánh giá như thế nào?
MAFLD có thể diễn tiến âm thầm qua nhiều giai đoạn, từ gan nhiễm mỡ đơn thuần đến viêm gan nhiễm mỡ, xơ hóa, xơ gan và cuối cùng là ung thư gan. Việc đánh giá mức độ bệnh giúp định hướng điều trị và tiên lượng lâu dài.

Siêu âm bụng là phương pháp đầu tay để phát hiện gan nhiễm mỡ, tuy nhiên độ nhạy hạn chế trong các trường hợp nhẹ. Kỹ thuật đo độ suy giảm tín hiệu (CAP) qua FibroScan (VCTE) có thể định lượng mức độ nhiễm mỡ với độ chính xác cao hơn và được dùng rộng rãi vì dễ thực hiện tại phòng khám. Dù vậy, CAP có thể cho kết quả không chính xác ở người béo phì và mối liên hệ giữa chỉ số CAP với kết cục lâm sàng vẫn chưa rõ ràng. MRI-PDFF là công cụ chính xác nhất để định lượng mỡ gan nhưng không phổ biến trong lâm sàng do chi phí cao.
Với nghiên cứu cộng đồng, có thể dùng các chỉ số sinh học như fatty liver index (FLI) để sàng lọc. Với viêm gan nhiễm mỡ, các xét nghiệm máu thông thường như ALT không đủ chính xác. Chỉ số FAST (kết hợp CAP, độ đàn hồi gan và AST) có thể giúp phát hiện viêm và xơ hóa mức độ nặng với độ nhạy và đặc hiệu cao. Tuy nhiên, hiện vẫn chưa có xét nghiệm nào thay thế được sinh thiết gan trong chẩn đoán chính xác viêm gan nhiễm mỡ.
Đối với đánh giá xơ hóa, các phương pháp không xâm lấn như FibroScan, Shear Wave Elastography, chỉ số FIB-4, NFS… được khuyến nghị để sàng lọc nguy cơ xơ gan nặng. Dù có thể loại trừ trường hợp nguy cơ thấp, độ chính xác khi xác định xơ hóa mức độ nặng còn hạn chế và có thể cần kết hợp nhiều phương pháp hoặc xác nhận bằng sinh thiết.
Sinh thiết gan không được chỉ định thường quy nhưng vẫn cần thiết trong một số trường hợp khi chẩn đoán không rõ ràng, kết quả các xét nghiệm không xâm lấn mâu thuẫn hoặc khi cần đánh giá chính xác mức độ xơ hóa cho mục đích điều trị hay nghiên cứu lâm sàng giai đoạn muộn. Tuy nhiên, sinh thiết cũng có những hạn chế như sai số lấy mẫu, chi phí cao và có nguy cơ biến chứng nhỏ.
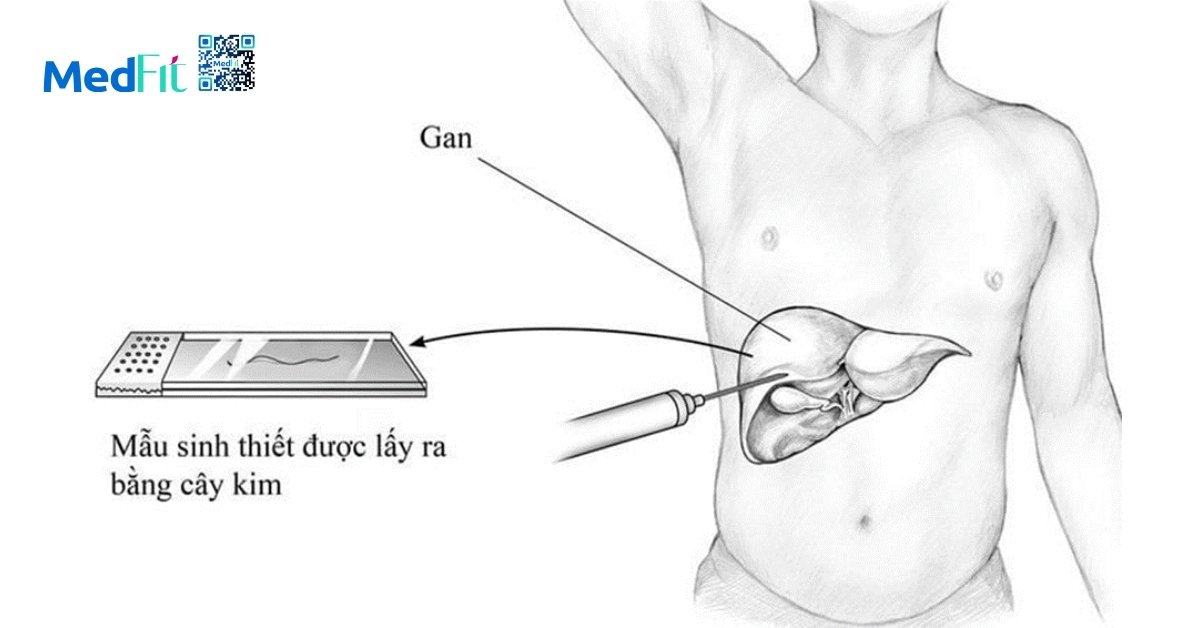
Hiện chưa khuyến cáo sàng lọc MAFLD diện rộng trong cộng đồng nhưng việc chủ động phát hiện ở nhóm nguy cơ cao là cần thiết. Siêu âm gan là công cụ phổ biến, dễ tiếp cận để phát hiện gan nhiễm mỡ. Đặc biệt, người mắc T2DM cần được ưu tiên đánh giá gan vì họ có nguy cơ cao hơn tiến triển đến viêm gan nhiễm mỡ, xơ hóa nặng, mất bù gan và ung thư gan.
Ngoài ra, những người thừa cân, béo phì hoặc có ít nhất hai yếu tố chuyển hóa (tăng huyết áp, rối loạn lipid máu…) cũng nên được đánh giá gan định kỳ. Việc kiểm tra nên bao gồm siêu âm và các xét nghiệm máu cơ bản như men gan (ALT, AST), tiểu cầu cũng như các chỉ số ước tính xơ hóa như FIB-4, NFS nếu cần.
Khuyến nghị điều trị lối sống và can thiệp chuyển hóa
Để kiểm soát hiệu quả MAFLD và béo phì, các hướng dẫn điều trị hiện nay nhấn mạnh vai trò trung tâm của việc thay đổi lối sống. Dưới đây là những khuyến nghị chính giúp cải thiện tình trạng bệnh, ngăn ngừa tiến triển và nâng cao chất lượng sống cho người bệnh:
Giảm cân và chế độ ăn là nền tảng điều trị MAFLD
Thay đổi lối sống, bao gồm điều chỉnh chế độ ăn uống và tăng cường vận động, là liệu pháp điều trị đầu tay và hiệu quả nhất hiện nay đối với MAFLD. Đặc biệt, ở bệnh nhân thừa cân hoặc béo phì, việc giảm 5-10% trọng lượng cơ thể mang lại nhiều lợi ích mô học:
- Giảm ≥ 5% giúp giảm mỡ gan.
- Giảm 7-10% có thể làm thoái lui tình trạng viêm gan do mỡ (MASH).
- Giảm > 10% góp phần cải thiện xơ hóa gan.
Để đạt được mức giảm cân này, khuyến nghị áp dụng chế độ ăn giảm năng lượng, tổng lượng calo hàng ngày khoảng 1200-1800kcal hoặc giảm 500-750kcal/ngày so với nhu cầu duy trì. Ngoài ra, nên kết hợp với theo dõi cân nặng định kỳ (ít nhất 1 lần/tuần) để kiểm soát hiệu quả lâu dài.
Nguyên tắc dinh dưỡng trong điều trị MAFLD
Chế độ ăn dành cho người mắc MAFLD cần được xây dựng dựa trên sở thích ăn uống, điều kiện văn hóa – xã hội và khả năng thực hiện của từng cá nhân. Tuy nhiên, dù có điều chỉnh thế nào, vẫn cần tránh một số nhóm thực phẩm có khả năng làm nặng thêm tình trạng gan và rối loạn chuyển hóa. Đó là các thực phẩm chứa nhiều đường bổ sung như nước ngọt, bánh kẹo công nghiệp, các loại thực phẩm chế biến có chứa fructose, sucrose hoặc siro ngô hàm lượng fructose cao (HFCS).

Bên cạnh đó, cần hạn chế chất béo bão hòa như dầu cọ, mỡ động vật vì làm tăng tích tụ mỡ trong gan. Một nhóm thực phẩm đặc biệt nên hạn chế là thực phẩm siêu chế biến, bao gồm các món ăn công nghiệp chứa nhiều đường, muối, chất béo và phụ gia, vốn đã được chứng minh liên quan đến nguy cơ gia tăng MAFLD, béo phì và hội chứng chuyển hóa.

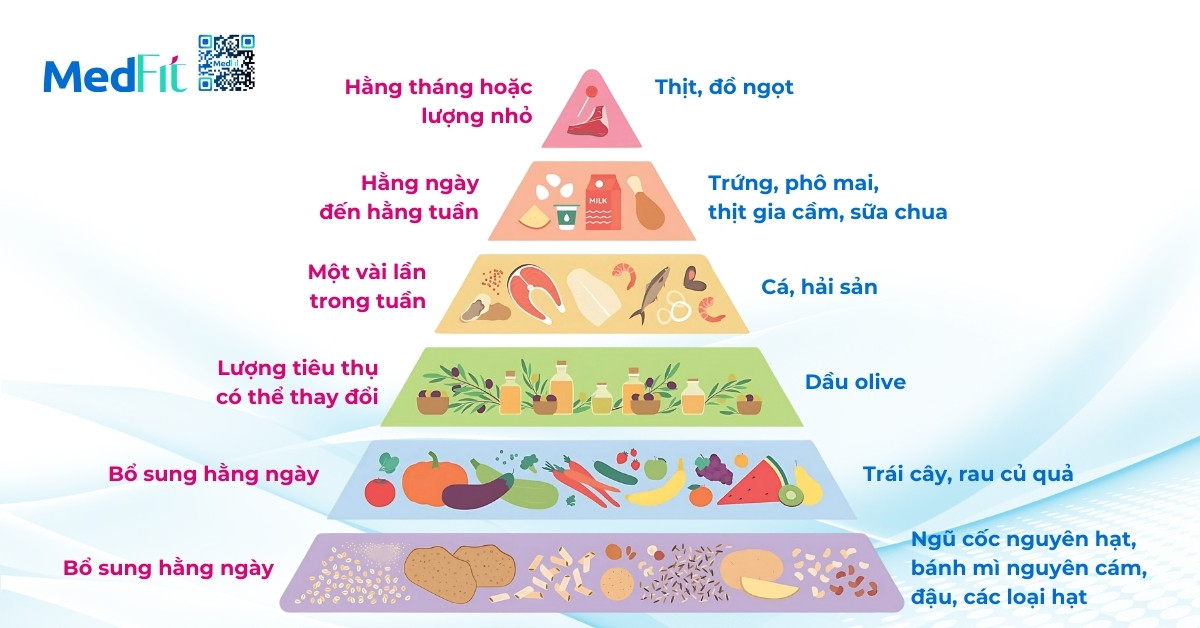
Chế độ ăn Địa Trung Hải (Mediterranean diet)
Đây là mô hình ăn uống được chứng minh có lợi nhất cho bệnh nhân MAFLD. Chế độ ăn này bao gồm:
- Hạn chế tinh bột tinh chế, đường và thực phẩm công nghiệp.
- Tăng cường chất béo có lợi như dầu olive và omega-3 từ cá béo.
- Tăng tiêu thụ rau xanh, hạt nguyên vỏ, trái cây tươi, cá và đậu.
Áp dụng chế độ ăn Địa Trung Hải giúp giảm nguy cơ T2DM, bệnh tim mạch, giảm mỡ gan và xơ hóa, thậm chí còn liên quan đến giảm nguy cơ ung thư gan. Tuy nhiên, để đảm bảo tuân thủ lâu dài, mô hình này cần được điều chỉnh linh hoạt sao cho phù hợp với khẩu vị địa phương.
Các chế độ ăn thay thế đang được nghiên cứu
Nhịn ăn gián đoạn (intermittent fasting) và giới hạn thời gian ăn (time-restricted feeding) giới hạn thời điểm ăn trong ngày hoặc trong tuần. Dù chưa có đầy đủ bằng chứng dài hạn, một số phân tích tổng hợp cho thấy các mô hình này giúp giảm cân, giảm mỡ gan, viêm gan và độ cứng gan ở người thừa cân hoặc béo phì mắc MAFLD.
Chế độ ăn keto (ít carb, nhiều chất béo) đã được ghi nhận ghi nhận giảm mỡ gan và trọng lượng cơ thể ở một số thử nghiệm nhỏ, nhưng không cải thiện xơ hóa. Vì vậy, chỉ nên áp dụng trong thời gian ngắn và có sự giám sát chuyên môn. Chưa có đủ dữ liệu về hiệu quả và độ an toàn khi áp dụng chế độ ăn keto lâu dài cho người MAFLD.
Một số nghiên cứu dịch tễ học và phân tích tổng hợp cho thấy rằng việc uống từ 3 ly cà phê trở lên mỗi ngày có thể liên quan đến nguy cơ mắc MAFLD thấp hơn và giảm mức độ xơ hóa gan. Những phát hiện này gợi ý rằng cà phê có thể đóng vai trò bảo vệ gan ở một mức độ nhất định. Tuy nhiên, do phần lớn các nghiên cứu này mang tính quan sát và chưa loại trừ hết các yếu tố gây nhiễu, nên hiện tại chưa đủ cơ sở để đưa ra khuyến cáo chính thức về việc sử dụng cà phê như một biện pháp điều trị hay dự phòng MAFLD.
Vận động thể lực nên được cá thể hóa và thực hiện đều đặn
Hoạt động thể chất đóng vai trò thiết yếu trong kiểm soát MAFLD và cần được đánh giá, hướng dẫn cụ thể, tối ưu là 150-240 phút/tuần cho hoạt động aerobic mức độ trung bình – cao (đi bộ nhanh, đạp xe, chạy bộ), đủ để giảm khoảng 30% mỡ gan tương đối và cải thiện chuyển hóa mà không phụ thuộc vào giảm cân. Tập cường độ cao ngắt quãng (HIIT) cũng mang lại lợi ích tương đương nếu được giám sát.
Tập kháng lực (resistance training) dù dữ liệu còn hạn chế nhưng được khuyến nghị bổ sung, nhất là ở người MAFLD có mất cơ, T2DM hoặc đang giảm cân nhiều bằng thuốc để ngăn mất cơ. Nên ưu tiên tập kháng lực 2-3 buổi/tuần.
Đa số người bệnh MAFLD có thể trạng yếu và bệnh nền tim mạch, do đó nên tiếp cận từ từ, có chỉ dẫn từ chuyên gia vận động để đảm bảo an toàn và cá nhân hóa chương trình tập.

Phẫu thuật dạ dày có thể cân nhắc trong trường hợp đặc biệt
Đối với bệnh nhân béo phì mức độ nặng, phẫu thuật giảm cân (bariatric surgery) như cắt dạ dày hình ống hoặc nối tắt dạ dày có thể xem xét khi các biện pháp giảm cân thông thường không hiệu quả. Phẫu thuật giúp giảm tới 30% cân nặng và cải thiện đáng kể tình trạng gan nhiễm mỡ, viêm và xơ hóa. Một số nghiên cứu cho thấy người châu Á đáp ứng tốt hơn với phẫu thuật về mặt cải thiện men gan và mô học gan. Tuy nhiên, ở người đã bị xơ gan, cần đánh giá kỹ nguy cơ biến chứng trước mổ, đặc biệt ở xơ gan mất bù.
Các kỹ thuật can thiệp nội soi không phẫu thuật (EBMT) như đặt bóng dạ dày, khâu tạo hình dạ dày nội soi… đang phát triển nhanh và cho kết quả khả quan về giảm cân và cải thiện mỡ gan nhưng dữ liệu dài hạn còn hạn chế. Nguy cơ biến chứng như chảy máu loét hoặc viêm phúc mạc cần được đánh giá kỹ lưỡng.
Điều trị bằng thuốc trong MAFLD
Trong khi thay đổi lối sống vẫn là nền tảng chính trong điều trị MAFLD, các nghiên cứu gần đây đã mở ra nhiều hướng đi mới với các liệu pháp dùng thuốc, đặc biệt dành cho những trường hợp bệnh tiến triển nặng hoặc không đáp ứng tốt với can thiệp không dùng thuốc. Dưới đây là tổng quan về các nhóm thuốc hiện có, đang được nghiên cứu và tiềm năng ứng dụng trong điều trị MAFLD:
Các thuốc điều trị đái tháo đường được ứng dụng trong MAFLD
Một số thuốc điều trị đái tháo đường đã và đang được nghiên cứu để ứng dụng trong điều trị MAFLD nhờ tác động kép, vừa cải thiện kiểm soát đường huyết, vừa có lợi cho gan:
Pioglitazone
Pioglitazone là thuốc nhóm thiazolidinedione (TZD) cho thấy hiệu quả rõ rệt trong cải thiện mô học gan ở bệnh nhân MASH, cả có và không có T2DM. Một thử nghiệm ngẫu nhiên mù đôi ở bệnh nhân châu Á kéo dài 24 tuần chứng minh rằng, pioglitazone có thể giảm mỡ gan và cải thiện viêm gan trên sinh thiết, đồng thời dung nạp tốt.
Tuy nhiên, thuốc có thể gây tăng cân và giữ nước nên cần cân nhắc kỹ đối với bệnh nhân có béo phì, suy tim hoặc loãng xương.
Ức chế SGLT2 (dapagliflozin, empagliflozin, canagliflozin)
Các thuốc ức chế đồng vận chuyển natri-glucose 2 (SGLT2i), vốn đã được sử dụng phổ biến trong điều trị T2DM và bệnh tim mạch, đang được nghiên cứu rộng rãi trong MAFLD. Các nghiên cứu ghi nhận rằng SGLT2i giúp giảm mỡ gan (qua MRI hoặc chỉ số CAP), cải thiện men gan (ALT, AST) và cải thiện một số chỉ số xơ hóa không xâm lấn (FIB-4, NFS).
Tuy nhiên, hầu hết các dữ liệu hiện tại chỉ dựa trên nghiên cứu ở bệnh nhân T2DM, rất ít nghiên cứu tập trung vào nhóm không đái tháo đường. Dữ liệu về cải thiện viêm gan và xơ hóa mô học còn hạn chế.
Một phân tích từ cơ sở dữ liệu bảo hiểm y tế quốc gia Hàn Quốc trên hơn 80.000 người cho thấy SGLT2i có hiệu quả vượt trội so với các thuốc khác như sulfonylurea, DPP4i và TZD trong việc giảm tỷ lệ nhập viện, tử vong và biến cố gan nghiêm trọng.
Metformin
Metformin là thuốc nền trong điều trị T2DM nhưng không cải thiện mô học gan ở người MAFLD. Tuy vậy, metformin giúp giảm đề kháng insulin và có thể làm giảm nguy cơ ung thư gan ở người bệnh – một lợi ích gián tiếp nhưng quan trọng.
Tuy nhiên, hiện chưa có bằng chứng thử nghiệm ngẫu nhiên đủ mạnh để đưa ra khuyến cáo chính thức về vai trò của metformin trong MAFLD không kèm T2DM.
Các thuốc hỗ trợ và chống oxy hóa khác
- Vitamin E: từng được cho là cải thiện mô học gan trong MASH nhưng các kết quả còn mâu thuẫn và lo ngại về nguy cơ ung thư tiền liệt tuyến hoặc tai biến xuất huyết khi dùng lâu dài.
- ACEI và ARB (thuốc ức chế men chuyển và ức chế thụ thể): có thể liên quan đến xơ hóa gan nhẹ hơn nhưng cần thêm dữ liệu chứng minh lợi ích rõ ràng.
- Aspirin: một nghiên cứu thử nghiệm lâm sàng cho thấy aspirin liều thấp có thể giúp giảm mỡ gan khi đánh giá bằng MRI, song vẫn cần xác nhận thêm.
- Statin: cải thiện chỉ số lipid và nguy cơ tim mạch nhưng chưa rõ tác dụng lên viêm gan hay xơ hóa.
Resmetirom – Thuốc đầu tiên được FDA Hoa Kỳ phê duyệt cho MASH
Resmetirom là chất chủ vận chọn lọc thụ thể tuyến giáp beta, được FDA Hoa Kỳ phê duyệt vào tháng 3/2024. Hai nghiên cứu pha 3 cho thấy thuốc có thể làm giảm mỡ gan, giảm viêm và cải thiện xơ hóa với độ an toàn tốt.
Thuốc được chỉ định cho bệnh nhân MASH đã xác định mô học hoặc có dấu hiệu xơ hóa mức F2-F3. Liều dùng tùy theo cân nặng (80mg nếu < 100kg hoặc 100mg nếu ≥ 100kg), cần Bác sĩ chuyên khoa đánh giá kỹ trước khi kê đơn. Hiện chưa rõ thời gian điều trị tối ưu và khi nào nên ngừng thuốc nếu không đáp ứng.

Nhóm thuốc đồng vận GLP-1 (GLP-1RA)
Bên cạnh hiệu quả trong kiểm soát đường huyết và hỗ trợ giảm cân, nhóm thuốc đồng vận thụ thể GLP-1 (GLP-1RA) đang được quan tâm ngày càng nhiều trong điều trị MAFLD.
Semaglutide
Semaglutide là thuốc tiêm thuộc nhóm GLP-1RA, hiện đang được sử dụng phổ biến trong điều trị T2DM và béo phì.
Trong một nghiên cứu pha 2b kéo dài 72 tuần, liều semaglutide 0,4mg/ngày đã giúp làm thoái lui MASH ở 59% bệnh nhân so với chỉ 17% ở nhóm dùng giả dược và không làm nặng thêm tình trạng xơ hóa gan. Tuy nhiên, hiệu quả cải thiện xơ hóa vẫn chưa đạt mức ý nghĩa thống kê.
Một nghiên cứu khác thực hiện trên bệnh nhân MASH đã có xơ gan giai đoạn F4 cho thấy semaglutide liều cao (2,4mg/tuần) không giúp cải thiện viêm gan hay xơ hóa. Điều này gợi ý rằng việc sử dụng GLP-1RA như semaglutide có thể mang lại hiệu quả tốt hơn nếu can thiệp ở giai đoạn sớm của bệnh, trước khi tổn thương gan tiến triển nặng.
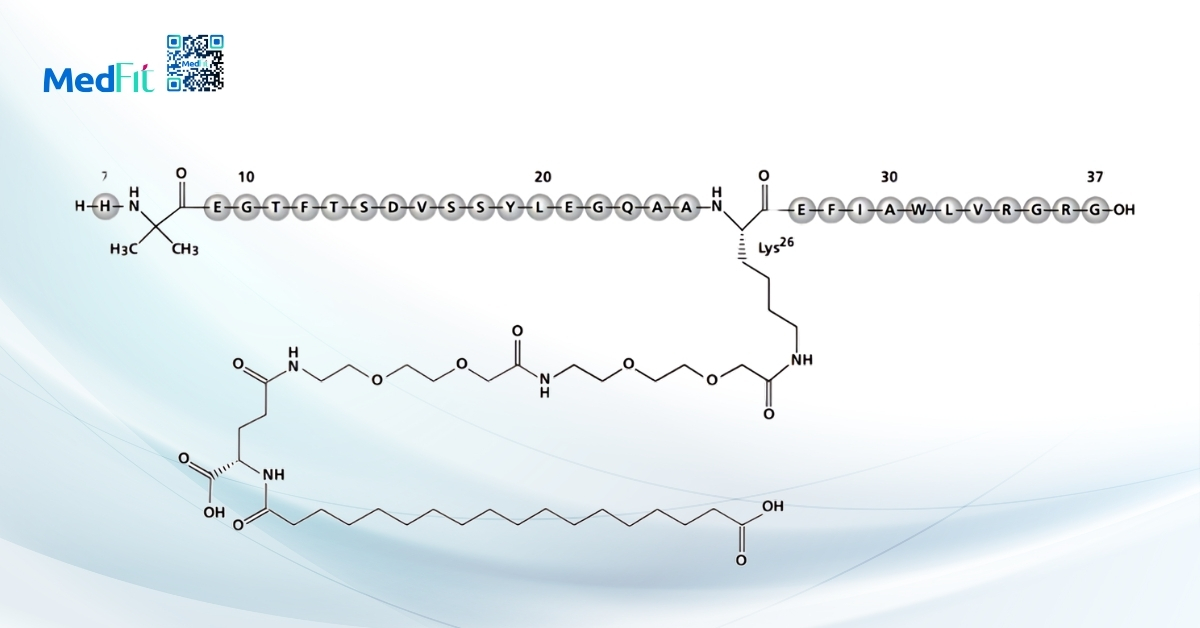
Tirzepatide (GIP + GLP-1RA)
Tirzepatide là thuốc tiêm tác động kép lên cả GIP (glucose-dependent insulinotropic polypeptide) và GLP-1, hiện đang cho thấy nhiều hứa hẹn trong điều trị MAFLD. Kết quả từ nghiên cứu pha 2 cho thấy thuốc giúp giảm cân nhanh và duy trì ổn định, đồng thời cải thiện đáng kể MASH và xơ hóa gan.
Tuy nhiên, dù dữ liệu ban đầu rất khả quan, hiệu quả và độ an toàn lâu dài của tirzepatide vẫn cần được xác nhận qua các thử nghiệm pha 3 quy mô lớn đang được triển khai.
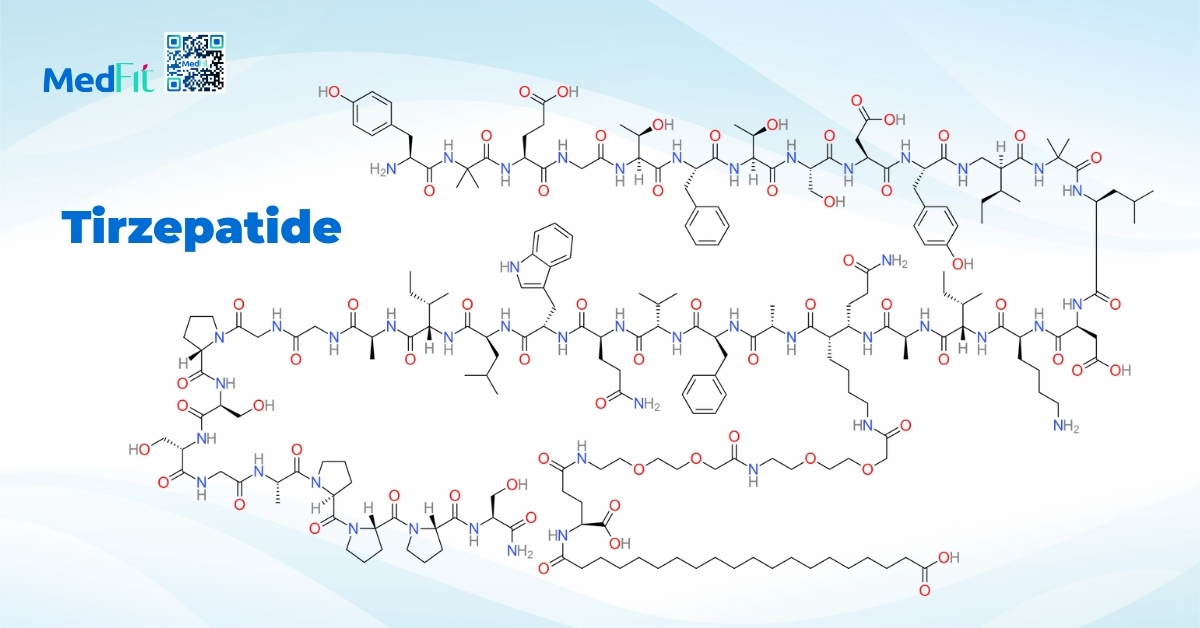
Survodutide (GLP-1 + glucagon)
Survodutide là một chất đồng vận kép tác động đồng thời lên GLP-1 và glucagon. Trong một nghiên cứu pha 2 ngẫu nhiên, thuốc cho thấy khả năng cải thiện mô học MASH. Dữ liệu thêm về xơ hóa và hiệu quả lâu dài vẫn đang được cập nhật.
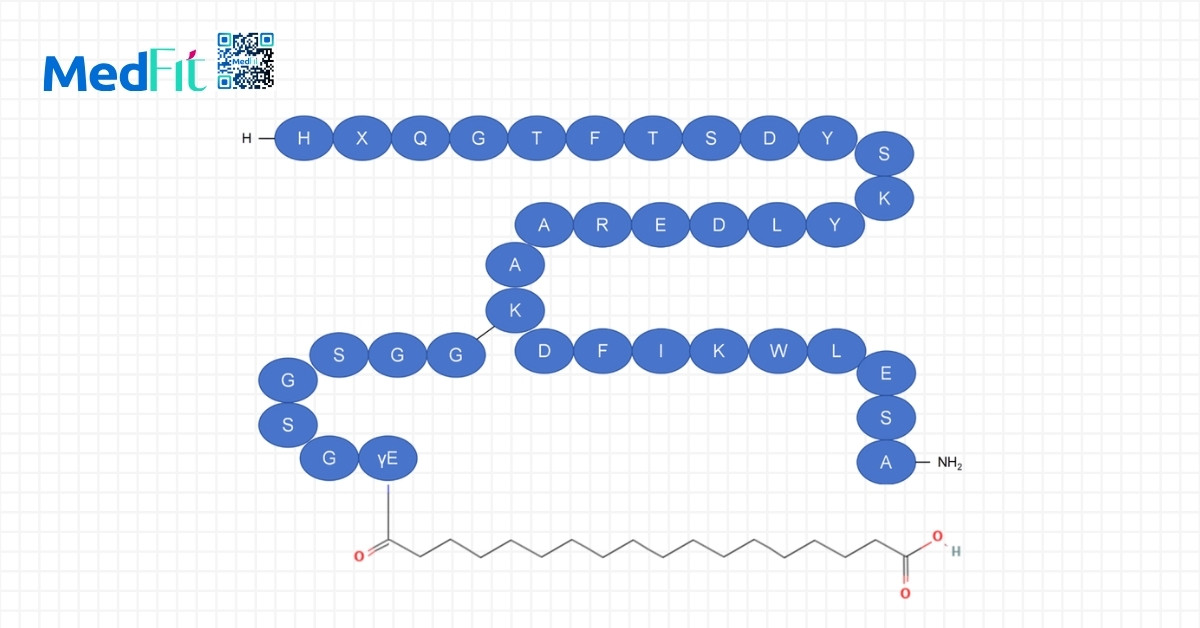
Lưu ý chung với nhóm GLP-1RA
Mặc dù nhóm GLP-1RA cho thấy hiệu quả rõ rệt trong việc giảm cân và cải thiện tình trạng gan nhiễm mỡ, nhóm này vẫn tồn tại một số hạn chế cần lưu ý:
- Các thuốc này thường được sử dụng dưới dạng tiêm dưới da định kỳ, gây bất tiện cho một số người bệnh.
- Ngoài ra, tác dụng phụ đường tiêu hóa như buồn nôn, nôn và tiêu chảy khá phổ biến, đặc biệt trong giai đoạn đầu điều trị.
- Một số trường hợp hiếm có thể gặp viêm tụy và khoảng 10% bệnh nhân phải ngừng thuốc do không dung nạp được.
Vì vậy, việc sử dụng nhóm thuốc này cần được cá nhân hóa và theo dõi chặt chẽ, nhất là ở những bệnh nhân đã có tổn thương gan tiến triển hoặc có nguy cơ gặp tác dụng phụ cao.
Các thuốc đang được nghiên cứu
Cùng với sự phê duyệt của resmetirom, hàng loạt thuốc mới đang trong giai đoạn thử nghiệm pha 2b và pha 3, mở ra hy vọng có thêm lựa chọn điều trị hiệu quả và đặc hiệu cho MASH/MAFLD.
Lanifibranor (pan-PPAR agonist)
Lanifibranor là một chất chủ vận toàn phần tác động đồng thời lên ba thụ thể PPAR (PPAR-α, PPAR-δ và PPAR-γ), có vai trò điều hòa chuyển hóa lipid, kiểm soát viêm và ức chế tiến triển xơ hóa gan.
Trong nghiên cứu pha 2b (NATIVE trial), lanifibranor cho thấy hiệu quả vượt trội so với giả dược khi giúp tỷ lệ thoái lui MASH mà không làm nặng thêm tình trạng xơ hóa cao hơn đáng kể, đồng thời cải thiện mức xơ hóa gan từ một giai đoạn trở lên mà không làm nặng thêm viêm gan.
Với những kết quả tích cực ban đầu, lanifibranor hiện đang được tiếp tục đánh giá trong các thử nghiệm pha 3 và được kỳ vọng sẽ trở thành ứng viên đầu tiên có tác động kép đáng tin cậy lên cả hai cơ chế bệnh sinh then chốt của MAFLD, là viêm gan nhiễm mỡ và xơ hóa gan.
Efruxifermin (EFX) – chất tương tự FGF-21
Efruxifermin (EFX) là một chất tương tự fibroblast growth factor-21 (FGF-21), một loại hormone có vai trò quan trọng trong điều hòa chuyển hóa năng lượng và chất béo trong cơ thể. Trong nghiên cứu pha 2a (BALANCED study), EFX cho thấy hiệu quả rõ rệt khi giúp giảm đáng kể mỡ gan (đánh giá bằng MRI-PDFF), đồng thời thoái lui MASH và cải thiện xơ hóa gan trên sinh thiết ở tỷ lệ cao. Bên cạnh đó, thuốc còn giúp cải thiện men gan, chỉ số lipid máu và tăng độ nhạy insulin, góp phần điều chỉnh toàn diện các rối loạn chuyển hóa đi kèm.
EFX được dùng bằng đường tiêm dưới da, dung nạp tốt và hiện đang được tiếp tục đánh giá trong các nghiên cứu pha 3 với thời gian theo dõi dài hơn để xác nhận hiệu quả và tính an toàn lâu dài.
Pegozafermin – chất tương tự FGF-21 thế hệ mới
Pegozafermin là một chất tương tự FGF-21 có thời gian bán thải kéo dài, được thiết kế để tiêm 1 lần/tuần, giúp thuận tiện hơn cho việc điều trị lâu dài. Trong thử nghiệm pha 2 (ENLIVEN study), thuốc cho thấy khoảng 30-40% bệnh nhân đạt được thoái lui MASH, đồng thời có tỷ lệ cải thiện xơ hóa gan mà không làm nặng thêm tình trạng viêm gan. Ngoài ra, pegozafermin còn giúp cải thiện đáng kể hồ sơ lipid máu và độ nhạy insulin, góp phần kiểm soát toàn diện các rối loạn chuyển hóa liên quan đến MAFLD.
Với kết quả tích cực bước đầu, thuốc hiện đang được triển khai trong nghiên cứu pha 3 với kỳ vọng trở thành một liệu pháp đa mục tiêu cho MAFLD, không chỉ tác động lên gan mà còn mang lại lợi ích cho tim mạch và chuyển hóa toàn thân.

* Voucher chỉ áp dụng cho khách hàng thăm khám lần đầu tiên tại Phòng khám MedFit
Làm thế nào để quản lý MAFLD và béo phì hiệu quả?
Trong điều trị MAFLD, người bệnh không chỉ là đối tượng tiếp nhận điều trị mà chính là nhân vật trung tâm quyết định hiệu quả lâu dài của quá trình chăm sóc. Việc thay đổi chế độ ăn uống, duy trì thói quen vận động và kiểm soát các bệnh lý đi kèm đòi hỏi sự chủ động, kiên trì và hiểu biết từ chính người bệnh.
Tuy nhiên, thực tế cho thấy mức độ nhận thức về MAFLD trong cộng đồng vẫn còn rất hạn chế, người bệnh thường không biết mình đang mắc bệnh gì, tại sao lại nguy hiểm và cần làm gì để cải thiện. Điều này khiến việc tuân thủ điều trị khó duy trì và dễ nản lòng, đặc biệt khi kết quả không đến ngay tức thì.
Để giúp người bệnh MAFLD vượt qua những khó khăn trong quá trình điều trị, cần xây dựng một chiến lược hỗ trợ toàn diện và thực tiễn hơn:
- Trước hết, người bệnh cần được cung cấp thông tin rõ ràng, dễ hiểu và đúng thời điểm, giúp họ hiểu được tình trạng sức khỏe của bản thân cũng như những việc cần làm để cải thiện.
- Bên cạnh đó, việc có người đồng hành đáng tin cậy như Bác sĩ, chuyên viên tư vấn hoặc điều dưỡng sẽ giúp người bệnh giải đáp các thắc mắc, định hướng từng bước và duy trì động lực thay đổi.
- Không kém phần quan trọng là hỗ trợ về mặt tâm lý và cảm xúc, giúp người bệnh vượt qua cảm giác lo lắng, mệt mỏi hay chán nản trong hành trình điều trị lâu dài.
- Cuối cùng, cần tạo điều kiện thuận lợi để theo dõi sức khỏe thường xuyên, bao gồm việc tiếp cận xét nghiệm định kỳ, cập nhật chỉ số chuyển hóa và đánh giá tiến triển một cách sát sao, giúp người bệnh an tâm và chủ động hơn trong việc chăm sóc bản thân.
Để hỗ trợ người bệnh tốt hơn, cần triển khai mô hình chăm sóc đa chuyên khoa tích hợp, nơi các Bác sĩ chuyên ngành như gan mật, nội tiết, tim mạch, thận, dinh dưỡng và vận động trị liệu cùng phối hợp trong một hệ thống thống nhất. Mô hình này không chỉ giúp điều trị toàn diện mà còn tiết kiệm thời gian, chi phí và nâng cao sự hài lòng của người bệnh.

Tại Việt Nam, các cơ sở chuyên sâu và đa chuyên khoa về điều trị thừa cân, béo phì như MedFit đang đóng vai trò nền tảng quan trọng trong quản lý MAFLD. Với định hướng tập trung vào kiểm soát cân nặng, cải thiện thói quen sống và điều trị rối loạn chuyển hóa đi kèm, MedFit mang đến một mô hình chăm sóc tích hợp, phù hợp với bản chất đa hệ thống của MAFLD. Tại đây, người bệnh được tiếp cận với đội ngũ đa chuyên khoa, gồm Bác sĩ Dinh dưỡng, Nội tiết, chuyên gia dinh dưỡng và vận động theo sát từng giai đoạn điều trị. Các chỉ số về chức năng gan, mỡ nội tạng, đường huyết và khả năng vận động đều được đánh giá một cách toàn diện. Từ đó, mỗi cá nhân sẽ có một lộ trình điều trị cá nhân hóa, tập trung vào giảm cân bền vững và kiểm soát chuyển hóa – hai yếu tố then chốt giúp làm chậm tiến triển MAFLD và ngăn ngừa biến chứng gan nặng.

Việc điều trị MAFLD không thể tách rời khỏi chiến lược kiểm soát béo phì và MedFit chính là điểm giao thoa giữa chuyên môn chuyển hóa và chăm sóc, lấy người bệnh làm trung tâm trong xu hướng điều trị hiện đại. Nếu bạn đang lo lắng về gan nhiễm mỡ hay gặp khó khăn trong kiểm soát cân nặng, đừng để tình trạng này kéo dài âm thầm. Hãy liên hệ MedFit để được thăm khám, tư vấn và thiết kế lộ trình điều trị cá nhân hóa cùng đội ngũ chuyên gia chuyển hóa giàu kinh nghiệm, bắt đầu hành trình thay đổi sức khỏe toàn diện.

Tài liệu tham khảo
- Lim GEH, Tang A, Ng CH, et al. An Observational Data Meta-analysis on the Differences in Prevalence and Risk Factors Between MAFLD vs NAFLD. Clin Gastroenterol Hepatol. 2023;21(3):619-629.e7. doi:10.1016/j.cgh.2021.11.038
- Danpanichkul P, Kongarin S, Permpatdechakul S, Polpichai N, Duangsonk K, Manosroi W, Chaiyakunapruk N, Mousa OY, Kim D, Chen VL, et al. The Surreptitious Burden of Nonalcoholic Fatty Liver Disease in the Elderly in the Asia-Pacific Region: An Insight from the Global Burden of Disease Study 2019. Journal of Clinical Medicine. 2023; 12(20):6456. https://doi.org/10.3390/jcm12206456 Chicago/Turabian Style
- Eslam M, Sarin SK, Wong VW, et al. The Asian Pacific Association for the Study of the Liver clinical practice guidelines for the diagnosis and management of metabolic associated fatty liver disease. Hepatol Int. 2020;14(6):889-919. doi:10.1007/s12072-020-10094-2
- Fan J, Luo S, Ye Y, et al. Prevalence and risk factors of metabolic associated fatty liver disease in the contemporary South China population. Nutr Metab (Lond). 2021;18(1):82. Published 2021 Sep 8. doi:10.1186/s12986-021-00611-x
- Eslam M, El-Serag HB, Francque S, et al. Metabolic (dysfunction)-associated fatty liver disease in individuals of normal weight. Nat Rev Gastroenterol Hepatol. 2022;19(10):638-651. doi:10.1038/s41575-022-00635-5
- Ampuero J, Aller R, Gallego-Durán R, et al. The effects of metabolic status on non-alcoholic fatty liver disease-related outcomes, beyond the presence of obesity. Aliment Pharmacol Ther. 2018;48(11-12):1260-1270. doi:10.1111/apt.15015
- Chun HS, Lee M, Lee HA, et al. Association of Physical Activity With Risk of Liver Fibrosis, Sarcopenia, and Cardiovascular Disease in Nonalcoholic Fatty Liver Disease. Clin Gastroenterol Hepatol. 2023;21(2):358-369.e12. doi:10.1016/j.cgh.2021.12.043
- Kim HK, Bae SJ, Lee MJ, et al. Association of Visceral Fat Obesity, Sarcopenia, and Myosteatosis with Non-Alcoholic Fatty Liver Disease without Obesity. Clin Mol Hepatol. 2023;29(4):987-1001. doi:10.3350/cmh.2023.0035
- Kwak JH, Jun DW, Lee SM, et al. Lifestyle predictors of obese and non-obese patients with nonalcoholic fatty liver disease: A cross-sectional study. Clin Nutr. 2018;37(5):1550-1557. doi:10.1016/j.clnu.2017.08.018
- Yuan Q, Wang H, Gao P, et al. Prevalence and Risk Factors of Metabolic-Associated Fatty Liver Disease among 73,566 Individuals in Beijing, China. Int J Environ Res Public Health. 2022;19(4):2096. Published 2022 Feb 13. doi:10.3390/ijerph19042096










